
我们在前面的QM小课堂知晓了LUMO及LUMO Map的概念,并通过实例初步了解和学习了它们在有机合成中的应用。本章节我们将介绍运用前面所学内容,为多取代杂环分子设计合适的合成路线。
如果起始原料是多卤代的苯环,我们知道反应一般会遵循I > Br > Cl这个排序进行,但杂环体系中的多卤代底物就充满了不确定性。
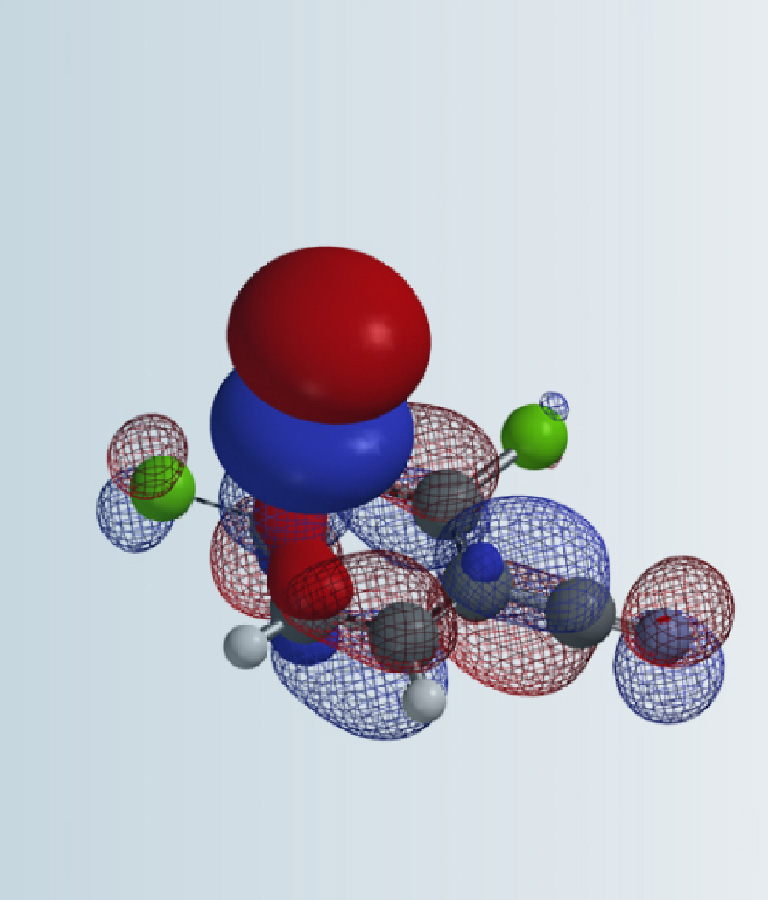
对于底物(1),2, 4, 5 位都为卤素,哪个位点优先引入取代基团呢?一般在 Pd[0]催化 C-X 键交叉偶联反应中,我们可以将 Pd[0]看做亲核试剂,它会优先进攻多个 C-X 键中具有较大 LUMO lobe 的碳。首先我们计算原料(1)的 LUMO:

图 1. 起始原料(1)的 LUMO 示意图
图 1 可知,LUMO 图示意只有 4-Cl 的碳有很明显的 LUMO lobe。因此,我们在钯催化下,并控制好反应温度在 70 °C,底物(1)可以与锡试剂 A 反应,选择性生成 C-4 位烯基化的化合物(2):

随后我们计算化合物(2)的LUMO(图 2):
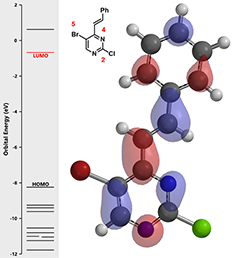
图2. 化合物(2)的LUMO示意图
嘧啶2位和5位的碳均没有明显的LUMO lobes,我们进一步参考LUMO+1的轨道能级示意图:

图3. 化合物(2)的LUMO+1示意图
LUMO+1 的示意图显示嘧啶 LUMO lobe 在 C-2 位和 C-5 位上(图 3),但二者差别不明显。那么此时你是否认为我们要随机试验,撞大运了呢?答案是当然是 NO!山人自有妙计!
这里我们再介绍一个小技巧:计算C-X键的红外(IR)的伸缩振动频率来预测区域选择性。伸缩振动频率相对低的C-X键,该键键能越弱,越容易断裂。
我们打开计算工具,计算化合物(2)中嘧啶2位和5位C-Cl键和C-Br键的红外线伸缩振动频率(图 4):

图 4. 化合物(2)的 LUMO+1 示意图和计算的红外伸缩振动频率
我们可以很直观的做出比较,5 位 C-Br 键(1165 cm-1)比 2 位 C-Cl 键(1191 cm-1)的键能弱,更易发生氧化加成反应,实现嘧啶 5 位基团的引入。值得注意的是,起始原料(1)的最低未占轨道能量为 -0.21 eV,化合物(2)的 LUMO+1 能级的能量为 0.62 eV,这就要求我们要提升反应体系的温度保证反应顺利进行。在相同催化体系下,升温至80 °C,化合物(2)与锡试剂 B 反应生成产物(3)。

最后一步反应,化合物(3)的 C-2 位没有 LUMO lobe,进一步考察 LUMO+1,其轨道能量比化合物(1)和(2)更高些,约为 0.70 eV(图 5)。
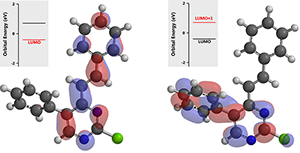
图 5. 化合物(3)的 LUMO(左)和 LUMO+1(右)示意图
这就需要再进一步提高反应强度,升高体系温度至 100 °C,可以成功得到 C-2 位芳基化的终产物(4)。

看完整个流程,您是否发现我们可以尝试在不改变催化剂和溶剂等条件下,仅仅通过改变反应温度,不同阶段加入不同的定量锡试剂,中间步骤不经过纯化,通过一锅法实现三个基团的顺序引入呢?
有没有超简单的感觉?提前计算一下,比没思路的盲目尝试节省大量的时间和精力!
总结一下,通过 QM 计算我们优先考虑各反应位点 LUMO 和 LUMO+1 lobe,如果不能明显判别,再继续计算红外伸缩振动频率比较,通过评估各活性官能团参与反应的活性顺序,在一个相对普通的反应条件下,设计出一条简洁且经济的合成路线。
本期我们也留了一个案例供大家思考:
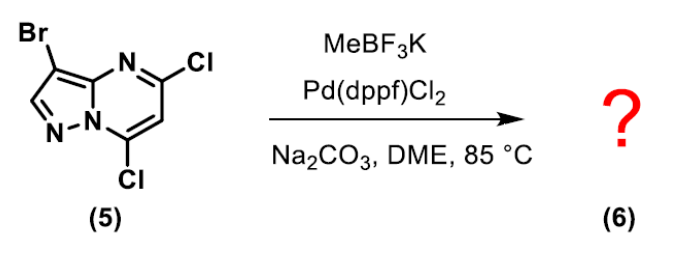
你能试着按上文所述的思路,参考如下所示的QM计算数据示意图给出一个合理的预测么?
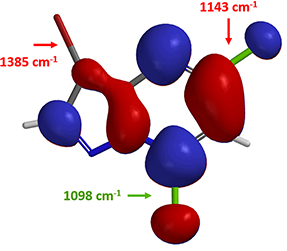
引入一个取代基后,第二个取代基会在哪里发生反应呢?

参考文献:
[1] W. Hehre and S. Ohlinger, A Guide to Molecular Mechanics and Quantum Chemical Calculations. Irvine, CA, USA: Wavefunction, Inc., 2003.
[2] J.A. Joule & K. Mills, Heterocyclic Chemistry 4th Ed. Malden, MA, USA: Blackwell Publishing Ltd., 2000; pp 202.
[3] R.M. Badger, J. Chem. Phys. 1934, 2, 128.

