 选择语言
选择语言

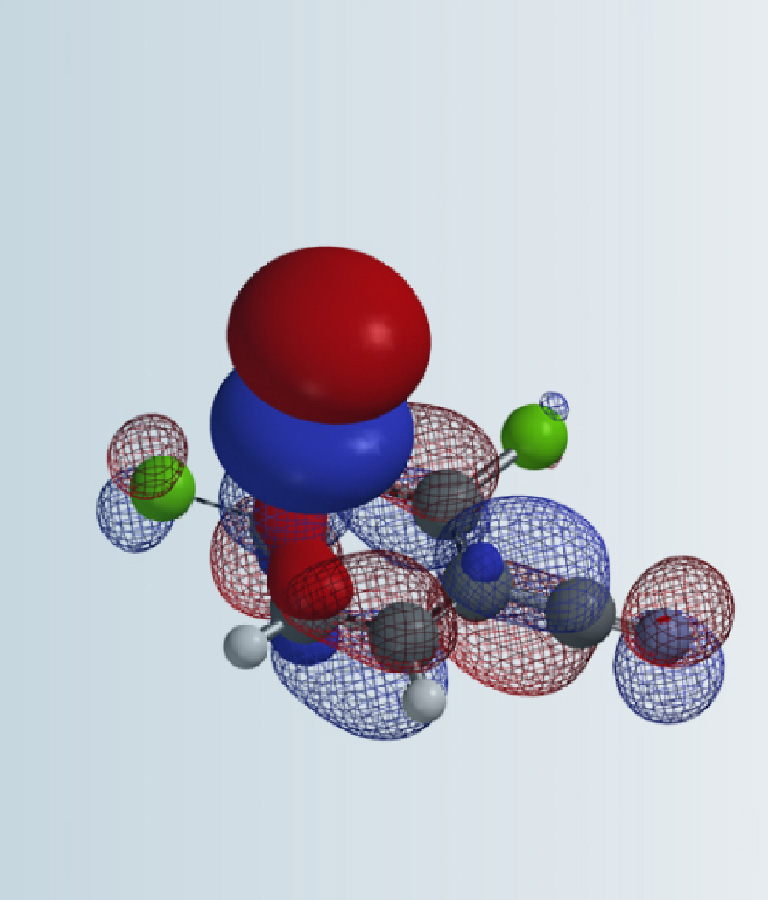
在前面QM魔法小课堂的第19章《揭开2,3-二氯吡嗪远程取代反应的面纱》中,我们学习了为什么2,3-二氯吡嗪会使用LUMO+1来进行亲核反应。本章将向大家展示如何选择LUMO 或LUMO+1和HOMO或HOMO-1轨道来解释和预测杂环化合物亲核和亲电反应的活性顺序 [1]。
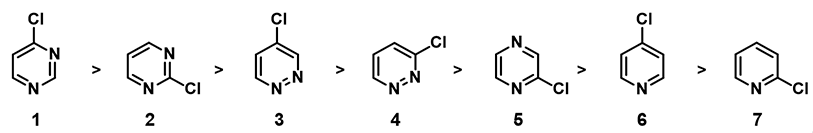
图1. 不同氯代杂环化合物亲核反应活性顺序
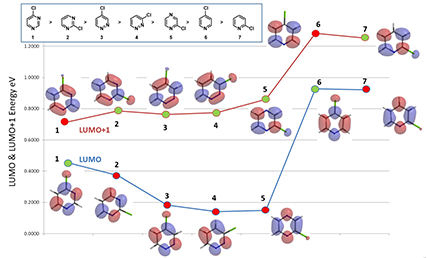
图2. 不同氯代杂环化合物的LUMO和LUMO+1轨道和能量
4-氯哒嗪3的C-Cl键上LUMO和LUMO+1轨道都有分布,那么该如何选择呢?我们分别从两方向进行了推断:1)实际反应活性:2-氯嘧啶2选用的是LUMO+1轨道能量参与反应活性的比较,它在实际实验中要比4-氯哒嗪3的活性高;从图2中可以看到3的LUMO轨道能量比2的LUMO+1轨道能量低0.6 eV,而它们的LUMO+1轨道能量比较接近,所以选用3的LUMO+1轨道能量用于反应活性的比较更为合理。
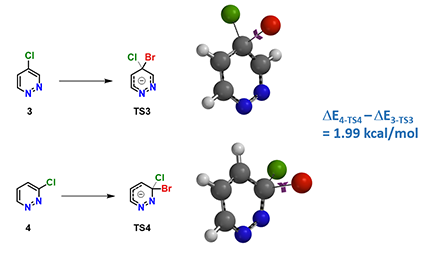
图3. 4-氯哒嗪3和3-氯哒嗪4被溴阴离子取代时的活化能量差
2)活化能量差:如图3所示,我们计算了结构非常相似的4-氯哒嗪3和3-氯哒嗪4被溴阴离子取代时的活化能,发现3至TS3的活化能比4至TS4的低,差值为1.99 kcal/mol,这与观察到的反应活性差别一致,因此我们参考化合物4,选用化合物3的LUMO+1轨道能量来参与反应活性的比较将会更合适。
我们通过以上两方面的分析,间接的推断选用了4-氯哒嗪3的LUMO+1轨道来比较反应活性,但是对于“为什么4-氯哒嗪有合适的LUMO轨道分布可以用于亲核反应,却使用LUMO+1 用于反应活性的比较呢?” 这一问题并没有真正的得到理解,有待进一步探索,同时也非常欢迎小伙伴们留言,一起进行讨论。
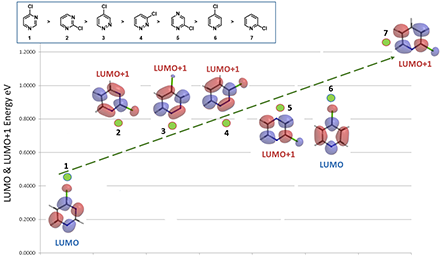
图4. 合适的LUMO、LUMO+1轨道能量反映氯代杂环化合物亲核反应的活性趋势
如图4所示,通过对以上七个氯代杂环化合物合适的LUMO/LUMO+1轨道能量的比较,可以观察到与它们亲核反应活性顺序有直接的相关性,关键在于选择合适的LUMO/LUMO+1轨道。
接下来我继续给大家介绍如何运用HOMO/HOMO-1来预测杂环化合物亲电反应的活性顺序。我们借助QM工具对图5中常见的八个五元、六元杂环化合物与亲电试剂的反应活性进行研究。
图5.常见的五元、六元杂环化合物
如图6所示,五元杂环化合物吡咯1、呋喃2和噻吩3的四个C上均有明显的HOMO轨道分布,所以选用HOMO轨道能量用于反应活性的比较;另外,C2位的Lobe明显大于C3位,这也合理的解释了C2位的反应活性高于C3位。由于苯4的结构完全对称,它的HOMO和HOMO-1轨道能量相同(同为 -8.78 eV),虽然它的每个HOMO轨道分布在两个碳原子上,但是HOMO-1轨道则集中在一个碳原子上。
六元杂环化合物——吡啶5、吡嗪6、嘧啶7和哒嗪8的HOMO 轨道在氮原子上有较明显的分布,而它们的HOMO-1轨道则主要分布在碳原子上,氮原子上很少或没有分布,所以选用它们的HOMO-1轨道能量用于在碳原子上亲电反应活性的比较。
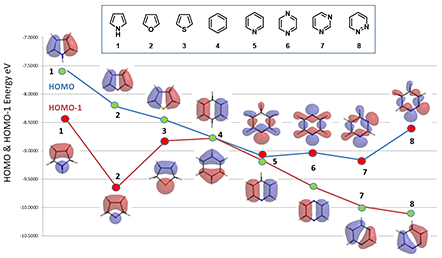
图6. 不同杂环化合物的HOMO和HOMO-1轨道和能量
如图7所示,通过以上八个杂环化合物HOMO/HOMO-1轨道能量的分析,我们可以很好的预测不同杂环化合物亲电取代反应的活性顺序;另外,从图中还可以看出:五元杂环化合物的反应活性明显高于六元杂环化合物,苯环可以作为五元、六元杂环的分界点,它的亲电取代反应活性低于五元杂环而高于六元杂环。
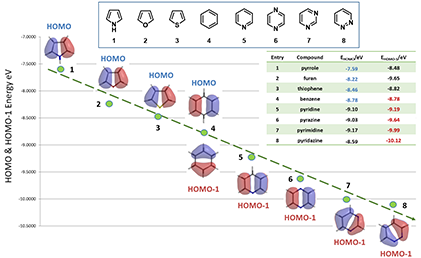
图7.合适的HOMO、HOMO-1轨道能量反映杂环化合物亲电反应的活性趋势
总结一下,本章我们通过两个案例,给大家展示了QM工具怎样用于解释或预测杂环化合物的亲核或亲电反应活性顺序的方法。对于不同的卤代杂环化合物,当它们的C-X键上有相当的LUMO轨道分布时,则应选用它们的LUMO轨道能量用于亲核反应活性的比较;当C-X键上LUMO轨道分布较少或没有,而其对应的LUMO+1轨道有着明显的分布时,则应选用它们的LUMO+1轨道能量用于亲核反应活性的比较;当C-X键上都有LUMO和LUMO+1轨道分布时,则需要结合它们的相对的活化能来辅助判断。与此类似,通过选择合适的HOMO/HOMO-1轨道能量则可以预测不同杂环化合物亲电反应的活性顺序。
图8. 吡啶在UHP、TFAA条件下制备吡啶氮氧化物的反应
吡啶氮氧化合物可以由吡啶和过氧酸(如过氧乙酸, m-CPBA等)反应来制备。那么吡啶氮氧化是使用HOMO还是HOMO-1呢?大家可以利用本章所学的有关知识来解释一下!如图8所示,Caron等人[3]报道了一种通过尿素过氧化氢络合物(UHP)和三氟乙酸酐(TFAA)氧化缺电子吡啶的方法,可以快速、高效的合成吡啶氮氧化合物。那么该方法为何特别对缺电子吡啶化合物起作用呢?小伙伴们,让我们一起来思考吧!
参考文献:
[1] L.G. Zhuo, W. Liao, Z.X. Yu, Asian J. Org. Chem. 2012, 1, 336.
[2] J.A. Joule & K. Mills. Heterocyclic Chemistry 5th Ed. Chichester, West Sussex, UK: Blackwell Publishing Ltd., 2010; p 256.
[3] S. Caron, N.M. Do, J.E. Sieser, Tetrahedron Lett. 2009, 41, 2299.
本文由周正权、潘东、董立亭、赖光华、卫小文编撰