 选择语言
选择语言

有机合成化学中,胺基保护是一个十分常见且重要的问题。其中Boc保护基,以其卓越的碱稳定性,以及高效简洁的脱除方法而备受青睐。一般脂肪族胺可以高效快捷地实现Boc保护,而亲核性较弱的芳胺则往往需要通过加热,延长反应时间,甚至加入强碱来实现Boc保护。
2006年,Tirayut Vilaivan报道了以醇为溶剂, 无需加碱而快速高效地实现芳胺Boc保护的方法(图1)[2]。核磁监测的反应动力学研究表明,该反应在MeOD中要比在CDCl3中快70倍。
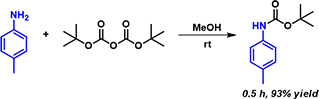
图1:甲醇参与芳胺的快速Boc保护
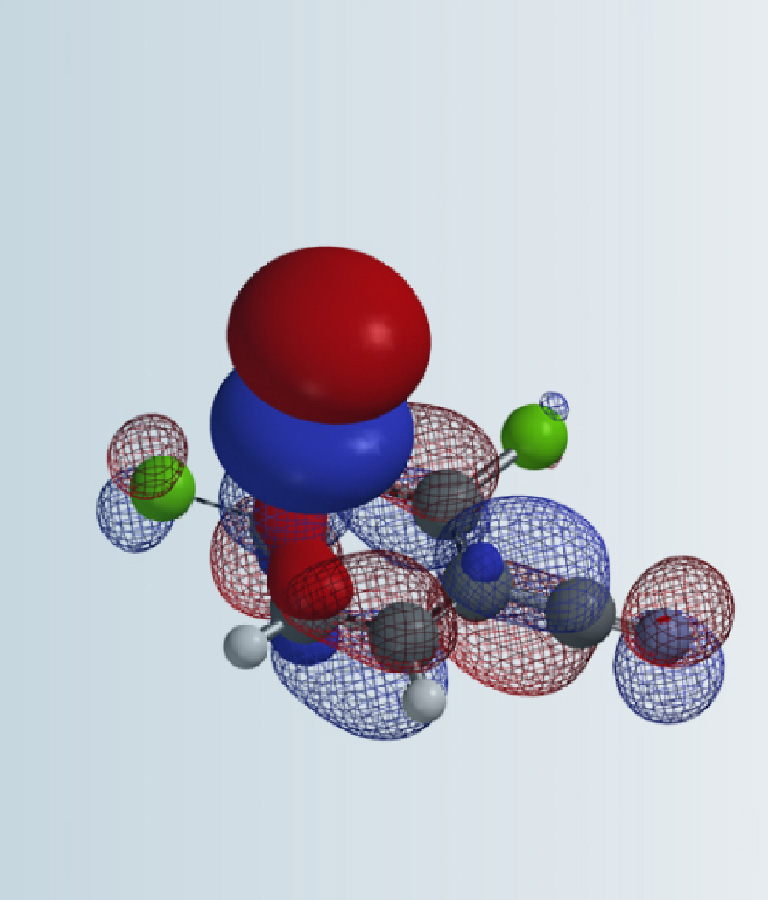
初步的QM分析显示,苯胺的其中一个N-H可能会和Boc酸酐中的羰基氧O1’形成氢键(图2A蓝色虚键),辅助苯胺的氮原子进攻Boc酸酐的另一个羰基碳C2(图2A粉色虚键)。因此在建立QM计算模型时,我们将N-C2的距离变化,设定为从彼此无相互作用的3.2 Å到共价键的成键距离1.4 Å,步长为0.1 Å。同时在苯胺的N-H与Boc酸酐的O1’之间建立联系,模拟可能存在的氢键作用(图2B)。通过模拟,我们计算得到,没有甲醇参与的情况下,苯胺Boc保护的活化能ΔE=16.22 kcal/mol(图4)。

图2:无甲醇参与的苯胺Boc保护反应的2D(A)与3D(B)模型构建
当有甲醇存在时,根据之前的QM分析,我们推测除了原有的苯胺N-H与Boc中准备离去的羰基氧O1’之间有氢键作用外(图3A蓝色虚键),甲醇可能会与苯胺的另一个N-H以及被进攻的羰基氧O2’之间形成额外的两个氢键(图3A红色虚键)。
我们以此建立反应初始模型(图3B),依旧是定义N-C2之间的距离从3.2 Å逐渐减小至1.4 Å,步长为0.1 Å。而且在这一模型里,同时在苯胺的N-H与Boc酸酐的O1’、苯胺N-H与甲醇的O、甲醇O-H与Boc酸酐的O2’之间建立联系,将这些可能存在的氢键作用都纳入模拟计算中。

图3:有甲醇参与的苯胺Boc保护的2D(A)与3D(B)模型构建
通过QM计算我们发现,在有甲醇参与的情况下,苯胺Boc保护的活化能ΔE=13.94 kcal/mol,比没有甲醇的情况低了2.28 kcal/mol (图4),这完全符合实验的结果——有甲醇参与时,苯胺Boc保护的速率会比没有甲醇时快得多。

图4:甲醇不参与(红)或参与(蓝)苯胺Boc保护的反应活化能对比示意图
氢键可以起到稳定反应过渡态的作用。那么上述两个反应的过渡态中,氢键的变化存在什么样的差异呢?我们分别选取两个过程中能量最高点的过渡态TS1和TS2来分析(图5)。
在无甲醇参与反应的过渡态TS1中,N-C2之间的距离为1.56 Å,接近成键距离,同时,苯胺的N-H与Boc酸酐中即将离去的羰基氧O1’之间的距离为1.96 Å,在氢键作用的范围内,即这一氢键会对该过渡态TS1产生一定的稳定作用。
在有甲醇参与反应的过渡态TS2中,N-C2之间的距离为1.46 Å,已经成键,苯胺的N-H与Boc酸酐中即将离去的羰基氧O1’之间也有氢键存在(1.88 Å)。而更关键的是,甲醇的存在,像一座桥梁,分别与Boc酸酐中的另一个羰基氧O2’,及苯胺的另一个N-H形成了额外的两根氢键(均为1.83Å),这两根氢键的存在进一步稳定了TS2,降低其能量,这也是导致2.28 kcal/mol能量差的主要原因。

图5:甲醇不参与(TS1)或参与(TS2)芳胺Boc保护的过渡态
此外,文章中提到,当反应底物为二级芳胺时,即使以甲醇为溶剂,其反应速率与一级芳胺相比却变慢了(图6A)。通过我们提出的反应过渡态可以很好地解释该现象:因为当底物为二级芳胺时,仅有一个N-H能与Boc酸酐中准备离去的羰基氧O1’之间形成氢键,没有第二个N-H与甲醇形成额外的氢键(图6B,TS3)来稳定反应过渡态。因此,即使体系内有甲醇,也无法有效降低反应过渡态的能量,加速反应。
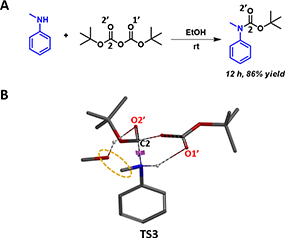
图6:甲醇参与二级芳胺Boc保护反应(A)及过渡态(B)
总结一下,通过QM计算,我们对于文献中报道的以醇为溶剂,可以显著提高芳胺Boc保护速率的现象进行了解释。我们认为,甲醇作为溶剂,同时与两个反应物产生氢键作用,形成了更为稳定的六元环过渡态,降低了反应的活化能,从而提高了反应速率。此外,使用二级芳胺时,由于没有额外的N-H可与甲醇形成氢键来稳定反应的过渡态,因此与一级芳胺相比,无法提升反应速率,这进一步验证了我们建立的反应过渡态QM模拟计算的合理性。
这一案例中,我们通过QM计算模拟反应过渡态、计算反应活化能来深入地理解有机反应机理,为我们合理解释反应现象、有效解决合成工作中的实际问题提供了宝贵的经验,也希望这些分享能为大家带来更多启发。
正文中我们通过QM计算模拟,阐述了甲醇通过氢键稳定反应过渡态,提高反应速率的作用。接下来,留给大家一个小问题,供您思考:有机合成中,为什么我们常使用醇类作为溶剂,在醋酸的催化下来实现γ-氨基酯的内酰胺化呢(图7)?
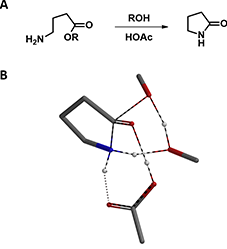
图7:γ-氨基酯的内酰胺化
温馨小提示:
在接下来的章节中,我们会继续分享利用QM建模、计算、理解反应机理的案例,敬请期待!
本文由张人伟、石谷沁、潘东、卫小文编撰。
参考文献:
[1] Warren J. Hehre. A Guide to Molecular Mechanics and Quantum Chemical Calculations. Irvine, CA, USA: Wavefunction, Inc., 2003.
[2] T. Vilaivan Tetrahedron Lett. 2006, 47, 6739.
[3] Our model is also consistent with the use of water or aqueous organic solvent in primary amine Boc protection, see Chankeshwara, S.V. & Chakraborti, A.K. Org. Lett. 2006, 8, 3259